El átomo |
DEFINICIONES PREVIAS: El átomo Un átomo es la mínima cantidad de materia que experimenta cambios químicos. La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleón, alrededor del cual se encuentra una nube de electrones de carga negativa. El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
|
Los nucleones se encuentran unidos entre sí por la llamada fuerza fuerte, de naturaleza equivalente a la gravitatoria, magnética o electrostática, pero a escala nuclear.
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. Según lo descrito anteriormente, el número atómico del hidrógeno es 1 (1H), y el del helio, 2 (2He).
La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1(1H), y el del helio, 4(4He).
El número másico, además, se define como la masa en gramos de sustancia que contiene una cantidad de 6,023 × 1023 átomos. éste es el llamado Número de Avogadro.
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos, y que tienen propiedades muy similares. Por ejemplo, existen tres isótopos naturales del hidrógeno, el protio (1H), el deuterio (2H) y el tritio (3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas.
 |
Alrededor del núcleo se encuentran los electrones, que son partículas elementales de carga negativa y con una masa de 9,10 × 10–31 kg.
La cantidad de electrones de un átomo en su estado base es igual a la cantidad de protones que contiene en el núcleo, es decir, al número atómico, por lo que un átomo en estas condiciones tiene una carga eléctrica neta igual a 0. A diferencia de los nucleones, un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un ion, una partícula con carga neta diferente de cero.
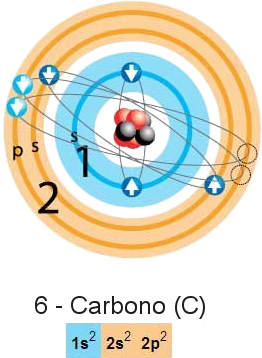
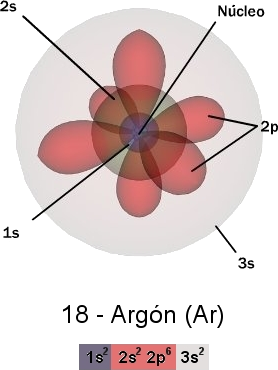
El concepto de que los electrones se encuentran en órbitas satelitales alrededor del núcleo se ha abandonado en favor de la concepción de una nube de electrones deslocalizados o difusos en el espacio, el cual representa mejor el comportamiento de los electrones descrito por la mecánica cuántica únicamente como funciones de densidad de probabilidad de encontrar un electrón en una región finita de espacio alrededor del núcleo.
 |
 |
Cuando los electrones de un átomo reciben energía son capaces de saltar a un nivel energético superior, y cuando ese electrón retorna a su estado original emite energía, normalmente en forma de luz.
Con estas bases los elementos se clasifican en períodos o filas en las que están todos los elementos con igual número de niveles energéticos, y en grupos o columnas, cuyos átomos tienen la misma configuración electrónica de la última capa.

Todos los átomos tienden a completar los electrones en su nivel energético más exterior, y ésto ofrece otra forma de clasificar los elementos. Se define la electronegatividad de un elemento como la tendencia que tiene a ceder o absorber electrones. Así existen elementos electropositivos que tienden a ceder electrones y formar iones positivos o cationes, y elementos electronegativos que aceptan electrones para formar iones negativos o aniones.
La escala de Pauling cuantifica la electronegatividad mediante un valor entre 0 (0,7 para el francio) y 4 (para el flúor). Globalmente puede decirse que la electronegatividad aumenta de izquierda a derecha en la Tabla periódica de los elementos y de abajo hacia arriba. De esta manera los elementos de fuerte electronegatividad están en la esquina superior derecha de la tabla.
 |
 |
 |
 |
