
Los diferentes elementos químicos se ordenan en la tabla periódica por número atómico creciente distribuidos en 4 bloques y 18 grupos. Una de las características peculiares de esta distribución es que aparecen tendencias en ciertas propiedades atómicas, entre ellas la electronegatividad.
A continuación vamos a repasar qué es la electronegatividad y como son las tendencias de electronegatividad en la tabla periódica.
Índice de contenido
¿Qué es la electronegatividad?
Gracias a los enlaces químicos, los diferentes elementos se combinan para formar las moléculas, compuestos y sustancias que conocemos. Estos enlaces siempre involucran a los electrones de las capas de valencia.
Cada elemento muestra una capacidad de atracción de los electrones de valencia diferente, y es esta capacidad lo que se conoce como electronegatividad.
La electronegatividad, por tanto, se define como una medida relativa de la capacidad de atracción que ejerce un átomo sobre los electrones de valencia cuando forma parte de un enlace químico.
Cuando dos átomos de elementos diferentes interaccionan entre sí, siempre habrá uno que ejerza mayor atracción sobre los electrones de valencia que el otro, es decir, siempre hay uno más electronegativo que el otro.
La diferencia de electronegatividad entre los dos átomos determina la intensidad y el tipo de enlace químico que se formará entre ellos.
Cuando la diferencia de electronegatividad es menor a 0.4 se forman enlaces covalentes no polares, si se sitúa entre 0.4 y 1.7 se forman enlaces covalentes polares, y si es mayor a 1.7 se forman enlaces iónicos.
No se debe confundir electronegatividad y afinidad electrónica, que mide la energía que se libera cuando un átomo gana un electrón.
La electronegatividad, por el contrario, es una medida comparativa entre el comportamiento de los átomos de unos elementos y los átomos de otros elementos, la electronegatividad no se mide en unidades de energía, sino en una escala relativa.
Escalas de electronegatividad
El flúor es el elemento de mayor electronegatividad. La electronegatividad del flúor es igual a 3.98, y atrae a los electrones de valencia de otros átomos con mayor fuerza que los átomos de cualquier otro elemento. Las medidas de electronegatividad para los demás elementos son relativas a este valor.
La primera escala de electronegatividad fue desarrollada por Linus Pauling, químico estadounidense que obtuvo el Nobel en 1954 por sus trabajos sobre el enlace químico.
En la actualidad existen otras escalas de electronegatividad, como la escala de Allred-Rochow, la escala de Sanderson o la escala de Allen, aunque la de Pauling sigue siendo la más utilizada.

Patrones de electronegatividad en la tabla periódica
De forma general, la electronegatividad aumenta de izquierda a derecha dentro de un período (filas horizontales en la tabla periódica), y disminuye de arriba hacia abajo dentro de un grupo (columnas verticales).
Se puede observar esta tendencia desde los metales alcalinos, que presentan la menor electronegatividad de toda la tabla periódica, hasta los halógenos, que presentan los mayores valores de electronegatividad. El flúor es el elemento más electronegativo de todos (EN = 3.98), y el cesio el menos electronegativo (E = 0.79).
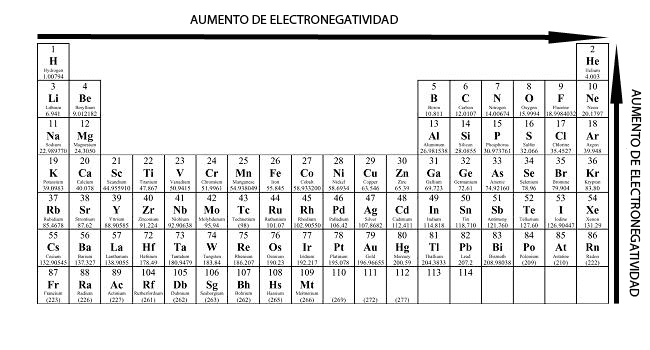
De izquierda a derecha, va aumentando el número de electrones en la capa de valencia, por lo que va aumentando la atracción de otros electrones para completar la capa de valencia y alcanzar un estado estable.
La disminución de electronegatividad al bajar en la tabla periódica se suele atribuir al aumento del radio atómico; la capa de valencia se va alejando del núcleo y con ello va disminuyendo la atracción que ejerce el núcleo sobre los electrones de valencia.
En este patrón general se pueden observar importantes excepciones en algunos tipos y series de elementos. Algunas de las más destacadas son los gases nobles. Una de las características de los gases nobles es contar con una capa de valencia completa, lo que les confiere una gran estabilidad y una electronegatividad prácticamente nula.
Otro patrón interesante se puede ver en los metales de transición. A lo largo de este numeroso grupo, la electronegatividad presenta baja variabilidad, tanto en los períodos como en los grupos, debido a que las características metálicas de estos elementos les hace atraer a los electrones con una facilidad similar entre ellos.
Además de poco variable, la electronegatividad de los metales suele ser baja. De hecho, tienen mayor facilidad para ceder electrones y transformarse en cationes, que para atraer electrones y formar aniones.
Resumen
- La electronegatividad es una medida relativa de la capacidad que tiene un átomo para atraer electrones cuando participa en un enlace químico.
- La electronegatividad suele aumentar de izquierda a derecha a lo largo de un período (filas de la tabla periódica).
- La electronegatividad suele disminuir al moverse hacia abajo en un grupo (columnas de la tabla periódica).
- Los gases nobles suelen presentar electronegatividad nula.
- La mayor electronegatividad la tiene el flúor (3.98). La menor electronegatividad la tiene el cesio (0.79).