|
| Temas de FC |
L.C. Blesa Baviera
Centro de Salud Serrería II. Valencia
| Resumen
La forma más frecuente de anemia microcítica es la anemia ferropénica. Otras causas de anemia microcítica son: la talasemia, la anemia de las enfermedades crónicas, la intoxicación por plomo y la anemia sideroblástica. En la anemia ferropénica, existe un fracaso de la función medular de síntesis de hemoglobina por falta de hierro; la ferropenia es un paso previo. La infancia presenta un elevado riesgo de ferropenia debido a las altas demandas de hierro por su rápido crecimiento y a la baja disponibilidad del mismo en su alimentación. Las causas pueden ser: disminución de la disponibilidad, aumento de las necesidades y/o aumento de las pérdidas. Clínica derivada del déficit de hierro y de la anemia, con posible repercusión en el desarrollo cerebral del niño. Diagnóstico casual o sugerido, con sucesión de acontecimientos bioquímicos y hematológicos conforme progresa la deficiencia, reflejados en los datos de laboratorio. El tratamiento debe ser etiológico siempre que sea posible; la suplementación oral constituye un pilar fundamental, al que se añade un adecuado aporte nutricional. Es recomendable una profilaxis con hierro oral en determinados grupos de riesgo. |
| Abstract
The most prevalent form of microcytic anemia is iron deficiency anemia. Other causes of microcytic anemia are thalassemia, anemia of chronic disease, lead poisoning and sideroblastic anemia. In the iron deficiency anemia a failure of the medullar function of hemoglobin synthesis exists for iron lack; iron deficiency is a previous step. Infants and children are at particular risk of iron deficiency due to high demands for iron during a period of rapid growth and because their diet is often low in available iron. The causes can be: decrease of the readiness, increase of the necessities and/or increase of the losses. The clinic will come derived of the iron deficiency and of the anemia, with possible repercussion in the brain development. Casual or suggested diagnosis, with succession of biochemical and hematological events according the deficiency progresses, reflected in the laboratory data. The treatment should be etiologic whenever it is possible; the oral supplementation constitutes a fundamental pillar, to which one adds a nutritional appropriate contribution. It is advisable a prevention with oral iron in certain groups of risk. |
Palabras clave: Anemia microcítica; Talasemia; Anemia ferropénica; Ferropenia.
Key words: Microcytic anemia; Thalassemia; Iron deficiency anemia; Iron deficiency.
Pediatr Integral 2012; XVI(5): 366-377
Anemias microcíticas. Anemia ferropénica
Anemias microcíticas
Una anemia es microcítica (Aµ), cuando el volumen corpuscular medio (VCM) es <2 desviaciones estándar del valor medio adecuado a su edad, en general <75 fl (<70 fl para el rango 6 meses – 2 años).
Introducción
Habitualmente, son también hipocromas e indican alteración de la síntesis del hem (hiporregenerativas) o de las cadenas de globina (regenerativas). Distinguimos:
1. Anemia ferropénica (AF) (se dedicará capítulo específico posterior).
2. Anemia de los trastornos crónicos (AEC).
3. Intoxicación por plomo (Pb).
4. Anemias sideroblásticas.
5. Talasemias.
6. Otras: déficit de cobre, hemoglobina (Hb) CC y Hb EE.
Anemia de las enfermedades crónicas
Aparece como complicación de procesos infecciosos y/o inflamatorios agudos y crónicos, en los procesos neoplásicos y en situaciones de daño tisular extenso (grandes quemados, fracturas múltiples…)(1).
Suele aparecer 1-2 meses después de iniciarse la causa. Pese a la diversidad causal y al mecanismo patogénico multifactorial, las alteraciones son similares, mediadas por citoquinas inflamatorias(1,2):
• Disminución de la vida media del hematíe.
• Falta de accesibilidad al hierro (Fe) por aumento en la síntesis de hepcidina, que provoca una disminución de la absorción intestinal y una dificultad en la liberación por los depósitos tisulares.
• Insuficiencia relativa de la médula ósea, asociada a una respuesta disminuida a la eritropoyetina (EPO); en las nefropatías, el factor principal es la disminución en la producción de EPO.
La AEC es, en general, normocítica y normocrómica, con amplitud de distribución del eritrocito (ADE) normal, aunque, en ocasiones, puede encontrarse una discreta microcitosis e hipocromía, por lo que la clasificamos también dentro de este grupo de Aµ; los reticulocitos son normales o bajos. Generalmente, los reactantes, como VSG y PCR, están elevados. El tratamiento(2) es el de la enfermedad de base y no debe administrarse Fe u otros hematínicos a no ser que se demuestre su deficiencia concomitante. Hay que valorar individualmente la administración de EPO recombinante humana (en este caso, administrar con Fe), sobre todo en los pacientes renales o neoplásicos. Las transfusiones rara vez están indicadas.
Intoxicación por Pb (saturnismo)
El Pb es un tóxico ambiental con diversas fuentes de exposición, variables según los países, y variados efectos deletéreos por su unión a enzimas, incluidas algunas implicadas en la síntesis del hem, su competitividad con el calcio y la afectación del desarrollo cerebral.
La vía de síntesis del hem cuenta con enzimas sensibles a los efectos inhibidores del Pb, especialmente la ferroquelatasa, última enzima de esta vía, por lo que no permite la quelación del Fe necesaria para la formación del grupo hem y se produce un acúmulo de protoporfirina eritrocitaria. La concentración sanguínea de Pb =10 µg/dl implica un riesgo que necesita tratamiento, aunque existe una considerable variabilidad interindividual(2). La sintomatología variará en función del grado de intoxicación, pero es sobre todo digestiva inespecífica y del sistema nervioso central (SNC) (alteraciones cognitivas y comportamentales, en ocasiones irreversibles, y aquellas derivadas del edema cerebral: cefalea, letargo, convulsiones y coma). El tratamiento consiste en medidas preventivas para evitar ingestas adicionales y farmacológico quelante para las intoxicaciones más graves.
Anemias sideroblásticas
Muy raras en los niños, de gravedad variable, se deben a trastornos hereditarios o adquiridos –fármacos, alcohol o procesos mielodisplásicos– en la síntesis del hem.
La alteración en la síntesis del hem conduce a la retención de Fe en las mitocondrias, apareciendo en la médula ósea eritrocitos nucleados con gránulos de Fe perinucleares conocidos como sideroblastos en anillo, distintos a los sideroblastos [precursores eritroides con gránulos de ferritina (Ft) citoplasmáticos difusos]. Producen unos hematíes microcíticos e hipocromos mezclados con eritrocitos normales, lo que se traduce en una ADE elevada; la sideremia y el índice de saturación de la transferrina (ISTf) están elevados(2).
Talasemias
Trastorno genético que produce una disminución (x+) o ausencia (x0) de la síntesis de una o varias cadenas de globina y acúmulo concomitante de otras.
Más frecuentes en el Mediterráneo, África, Oriente Medio y Sudeste Asiático. Existen dos bloques multigénicos: cadenas ß, d, ? y e en el cromosoma 11, y cadenas a y ? en el cromosoma 16. Hablamos de alfa-talasemias cuando afecta a la cadena a, y de beta-talasemias cuando la cadena ß es la afectada. La Hb es un tetrámero formado por dos pares de cadenas polipeptídicas llamadas globinas, cada una de ellas unida a un grupo hem –protoporfirina unida a un átomo de Fe central–. Existen seis tipos de globinas (a, ß, ?, d, e y ?) que, al combinarse, dan lugar a las distintas Hb: Hb del adulto: Hb A (a2ß2) y Hb A2 (a2d2); Hb fetal: Hb F (a2?2); Hb Bart (?4); Hb H (ß4); y Hb embrionarias: Hb Gower-1 (e2?2), Hb Gower-2 (a2e2) y Hb Portland (?2?2). Las a-talasemias se manifiestan intraútero o al nacimiento, pues la Hb F está formada por cadenas a, mientras que las ß-talasemias se manifestarán más tarde, cuando la Hb F haya descendido y la Hb A sea mayoritaria (a los 2-4 meses de edad)(1). Los eritrocitos presentan una vida media acortada(3). El tratamiento consiste en suplementos de folato [5 mg/día (d), en días alternos], posible esplenectomía y transfusiones en los casos más graves –con adición de quelantes del Fe si son repetidas para paliar la hemosiderosis secundaria–, y trasplante de médula ósea curativo en los casos homocigotos severos(2).
Alfa-talasemias
Pueden identificarse neonatalmente por la presencia de Hb Bart (?4) al nacimiento, pero en edades posteriores y en los casos leves la electroforesis de Hb es normal. Existen 4 genes de la globina a y 4 fenotipos de a-talasemia delecional, además de algunas mutaciones no delecionales, de las que la más frecuente es la Constant Spring (aCS), que comporta mayor gravedad.
• Deleción de 1 gen (-a/aa): portador asintomático.
• Deleción de 2 genes (-a/-a, –/aa): rasgo a-talasémico, asintomáticos.
• Deleción de 3 genes (–/-a) o enfermedad de Hb H (ß4): Aµ e hipocroma, hemolítica crónica, con aumento de los reticulocitos, desde el nacimiento; detección de Hb H en la electroforesis.
• Deleción de 4 genes o a-talasemia homocigota, con intensa anemia intrauterina e hidropesía fetal asociada.
Beta-talasemias
La cadena ß está codificada por dos genes, conociéndose más de 200 mutaciones, la mayoría raras. Las personas heterocigotas, con una mutación y un alelo normal (ß0/ß o ß+/ß), tienen el llamado rasgo ß-talasémico, ß-talasemia mínima o minor o ß-talasemia heterocigota; las personas homocigotas presentan la ß-talasemia maior o anemia de Cooley cuando las 2 mutaciones son graves (ß0/ß0), y hablamos de ß-talasemia intermedia cuando las 2 son moderadas (ß+/ß+) o 1 grave y 1 moderada (ß0/ß+), o bien se combina con otra hemoglobinopatía como la Hb S (rasgo falciforme) (S/ß0) o la Hb E (E/ß0). Aunque existe una asociación entre genética y clínica –según el grado de anemia se clasifican clínicamente como rasgo, mínima, menor, intermedia y mayor–, la clasificación genética no define necesariamente el fenotipo y el grado de anemia no siempre permite predecir su clasificación genética(1,2). Al existir un exceso de cadenas a se forman tetrámeros de la misma (a4), formando inclusiones que acortan la vida media eritrocitaria al interaccionar con la membrana. También, existirá un aumento de las cadenas d y ?, que se traducirá en una elevación de la Hb A2 y la Hb F, respectivamente. La anemia, de menor o mayor gravedad, es microcítica e hipocroma, con ADE y metabolismo del Fe normales. La electroforesis de Hb muestra elevación de Hb A2 y Hb F y disminución de Hb A (tanto más baja cuanto más grave es la ß-talasemia).
Otras talasemias
El trastorno genético, generalmente heterocigótico, afecta a otras cadenas conjuntamente (dß-talasemia y ?dß-talasemia, dada su distribución cromosómica) o aisladamente (?-talasemia y d-talasemia). Varían desde la normalidad (?-talasemia) a una Aµ leve-moderada (dß-talasemia y ?dß-talasemia), con patrón variable en la electroforesis de Hb (dß-talasemia: aumento de Hb F con Hb A2 normal o baja; ?dß-talasemia y ?-talasemia: disminución de Hb F; d-talasemia: ausencia de Hb A2)(2,3).
Otras
Deficiencia de cobre (Cu)
Prácticamente exclusiva de pacientes con nutrición parenteral completa prolongada con aporte deficiente de Cu. Además de Aµ, asocia leucopenia y alteraciones óseas, se confirma por ceruloplasmina y cupremia bajas y se corrige aportando Cu.
Algunas hemoglobinopatías cualitativas
La Hb C y la Hb E son variantes genéticas cualitativas de Hb, producto de la alteración en la estructura (y no en la cantidad) de las globinas. Cuando son heterocigóticas (Hb AC, Hb AE) son asintomáticas, pero si son homocigóticas (Hb CC o Hb EE) pueden cursar con Aµ leve.
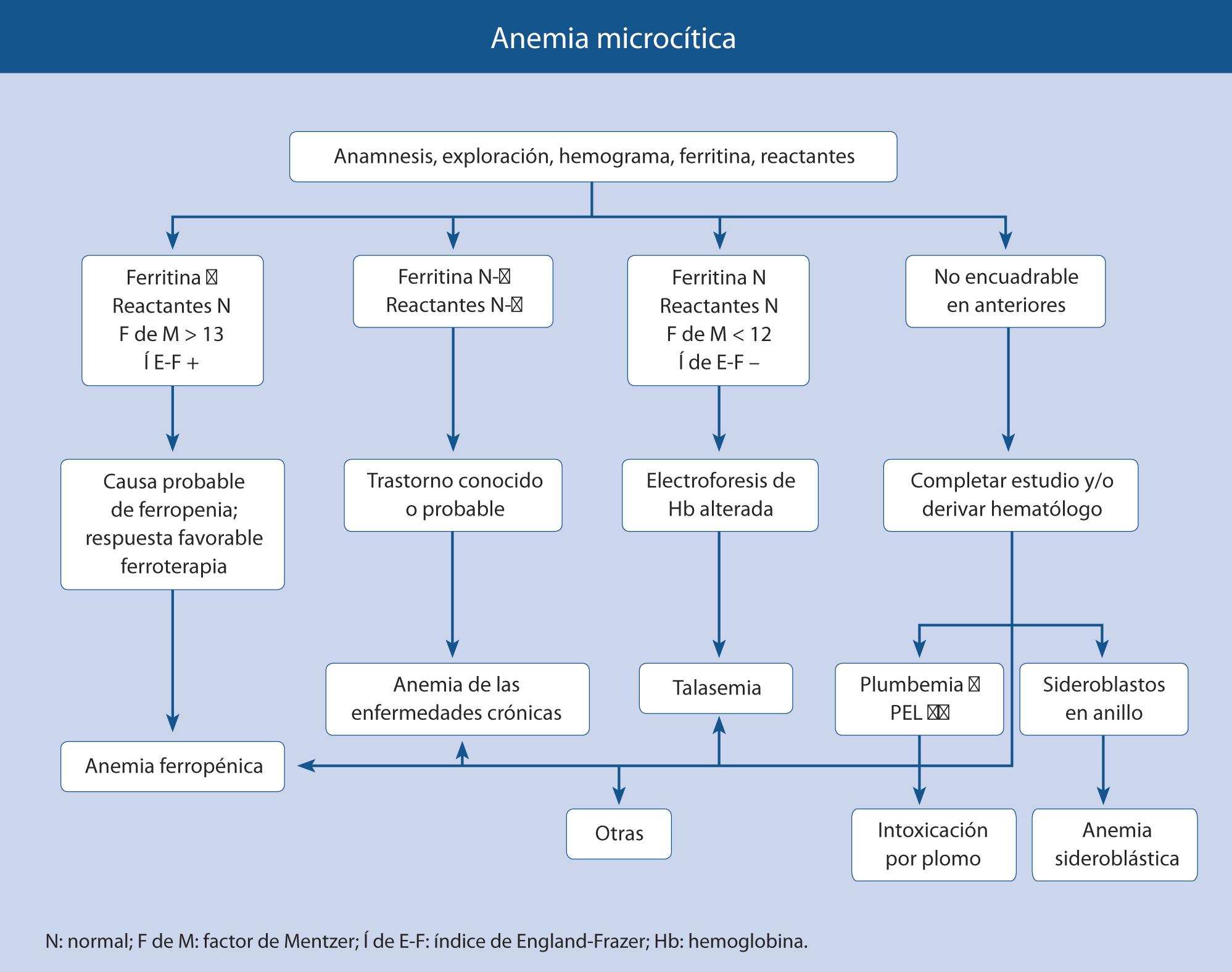
Diagnóstico diferencial de las anemias microcíticas
Generalmente, se nos plantearán dudas entre la AF-ferropenia (la más frecuente) y los rasgos talasémicos, pero también hay que tener presente la AEC y, en menor medida, la intoxicación por Pb(4) (Tabla I).
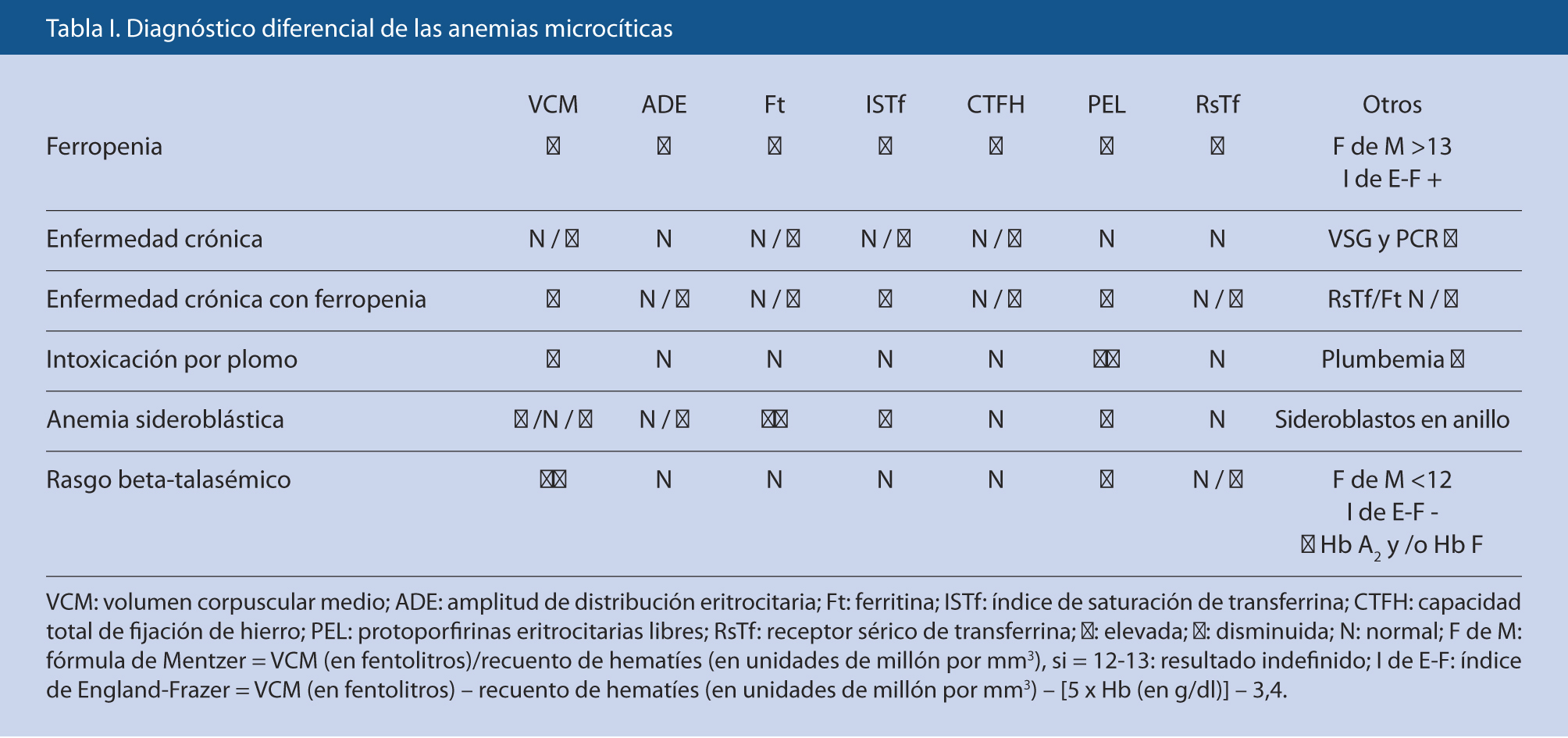
El rasgo beta-talasémico presenta alteración característica de la electroforesis de Hb (elevación de Hb A2 y/o de Hb F), parámetros férricos normales, Hb poco disminuida, aumento del número de hematíes y VCM bajo, desproporcionadamente bajo para la cifra de Hb. El rasgo alfa-talasémico comparte los hallazgos anteriores salvo la electroforesis de Hb generalmente normal, por lo que es un diagnóstico de exclusión (puede confirmarse por técnicas moleculares). Existen unos índices eritrocitarios (Mentzer y England-Frazer, los más conocidos) de fácil aplicación, que permiten diferenciar, aunque con sensibilidad y especificidad no excelentes(5), entre ferropenia y rasgo talasémico; no son útiles si coexisten ambas situaciones. En la intoxicación por Pb, además de unas protoporfirinas eritrocitarias muy elevadas, se observa un punteado basófilo eritrocitario característico y una cifra elevada de plumbemia. La AEC es normocítica o ligeramente microcítica, con sideremia e ISTf normales o bajos, pero, a diferencia de la AF, la Ft sérica –al igual que otros reactantes, como VSG o PCR–, está normal o elevada, la transferrina (Tf) es baja, el receptor de Tf en suero (RsTf) presenta valores normales y la capacidad total de fijación del Fe (CTFH) no aumenta. Cuando coexiste con AF el RsTf puede estar elevado, y es de utilidad la medición del cociente RsTf/Ft, que está aumentado (en la AF está muy elevado y en la AEC está normal o disminuido).
Anemia ferropénica
Introducción
La AF es la anemia producida por el fracaso de la función hematopoyética medular en la síntesis de Hb debido a la carencia de Fe.
Las principales funciones del Fe son fijar reversiblemente el oxígeno para su transporte o almacenamiento, así como aceptar y liberar electrones para generar fuentes inmediatas de energía(6). La ferropenia (FP) consiste en la deficiencia de los depósitos sistémicos de Fe y, dada la participación del Fe en diversas funciones biológicas, producirá efectos nocivos, especialmente en la infancia. Si esta situación se agrava o se mantiene en el tiempo, se desarrollará AF, con mayor repercusión clínica. Es la enfermedad hematológica más frecuente de la infancia.
Recuerdo fisiológico del metabolismo del hierro
El mecanismo principal para la regulación de la homeostasis del Fe es el grado de absorción intestinal, influido por el estado férrico del organismo, el contenido dietético, el transporte entre los órganos y la utilización tisular de Fe(7).
Ingesta
Contienen Fe una gran variedad de frutos secos, semillas, legumbres, verduras y frutas, lo que constituye el Fe vegetal o no hem (90%). El Fe hem o animal (10%) se encuentra, sobre todo, en carnes rojas, hígado y yema de huevo, pero también en pescados y otras carnes. La leche de vaca (LV) y la de mujer (LM) son relativamente pobres en contenido férrico (0,5-1 mg/L). Las fórmulas adaptadas de inicio enriquecidas en Fe (todas las presentes en nuestro país) poseen ˜ 7-9 mg/L, y una cantidad algo superior las de continuación, ˜ 10-13 mg/L(1).
Absorción enterocitaria
Alrededor del 10% del presente en los alimentos, en forma de complejos férricos (Fe no hem: ferroso o divalente y férrico o trivalente) en torno a un 3-8% y como parte del grupo hem (Hb y mioglobina) entre un 10-25%, pues este último se absorbe mucho mejor. El Fe de la LM se absorbe 2-3 veces mejor que el contenido en la LV. La acidez gástrica o la acción de una ferrirreductasa presente en el borde en cepillo del enterocito reduce la forma férrica (Fe+++) a ferrosa (Fe++), con absorción posterior, predominante a nivel duodenal, mediante la proteína transportadora de iones metálicos divalentes (DMT1)(6). En el interior del enterocito se oxida y se une a la apoferritina para formar Ft. Factores que aumentan la absorción: aumento de la ingesta de Fe, forma ferrosa, sustancias reductoras en la dieta, como la vitamina C, hipoxia tisular, aumento de la eritropoyesis y reducción de las reservas sistémicas de Fe. Factores que disminuyen la absorción: presencia en la dieta de sustancias que forman sales insolubles con el mismo (fitatos, oxalatos, tanatos, fosfatos, carbonatos, ácidos biliares), de metales divalentes que poseen el mismo mecanismo de absorción (cinc, cobre, cadmio, cobalto, manganeso, plomo), la administración de inhibidores de la acidez gástrica o quelantes y la sobrecarga férrica(8).
Paso a la sangre, transporte plasmático y captación celular
La Ft enterocitaria se reduce nuevamente en el polo vascular a forma ferrosa y apoferritina por acción de una ferrioxidasa llamada hefaestina. La forma ferrosa pasa a la sangre mediante otra proteína transmembrana, la ferroportina, y se une en su mayor parte a una betaglobulina, la Tf, aunque una pequeña proporción está unida a la apoferritina para constituir la ferritina sérica. Cada molécula de Tf posee dos sitios activos de unión para el Fe; en condiciones normales, sólo están ocupados un tercio de los sitios disponibles. Se conoce un inhibidor de la ferroportina, la hepcidina, de origen hepático, que evitaría la salida plasmática del Fe. Existe un receptor específico en las membranas celulares, el receptor de la Tf, que permite la incorporación del Fe al interior celular(6).
Distribución
• 0,1-0,2 % en plasma: Fe sérico.
• 65-70% en hematíes y eritroblastos maduros: Fe hemoglobínico (1 g de Hb = 3,5 mg de Fe).
• 5-10% en músculos: Fe mioglobínico.
• 1-3% en el interior celular: Fe enzimático.
• 22-30% en las células del sistema retículo-endotelial (SRE) y precursores medulares: Fe de depósito, en forma de ferritina y hemosiderina.
Pérdidas
Por heces, orina y piel, fundamentalmente por descamación celular, no regulables. Se calcula en unos 0,3-0,5 mg/d en el niño.
Ciclo endógeno
Los hematíes poseen una vida media aproximada de 120 días, al cabo de los cuales son retirados de la circulación por las células del sistema retículo-endotelial (SRE). Cada día se renuevan alrededor del 1% de los eritrocitos circulantes. El Fe liberado es almacenado en los depósitos férricos del SRE o pasa al plasma donde se une a la Tf, siendo de estas dos fuentes desde donde se reutiliza por los eritroblastos.
Particularidades en la infancia
El feto recibe el Fe a través de la placenta de manera activa, incluso en situaciones de carencia materna. Las reservas acumuladas intraútero y en las primeras semanas de vida, como consecuencia del descenso de las altas cifras de Hb neonatales, cubren los requerimientos del recién nacido sano a término durante los primeros 6 meses. El recién nacido posee aproximadamente 0,5 g de Fe, mientras que el adulto alrededor de 3-5 g, lo que implica que el crecimiento del niño precisa absorber diariamente una cantidad aproximada de 0,5-0,8 mg/d que, unida a la que precisa para contrarrestar las pequeñas pérdidas producidas por la descamación celular y las hemorragias, hace que las necesidades diarias de absorción de Fe sean de ˜ 0,8-1 mg. Si la absorción estimada es del 10%, la dieta diaria debe aportar unos 10 mg de Fe(2). En la adolescente fértil, se añaden unas pérdidas menstruales de 0,5-1,5 mg/d (promedio, 20 mg/mes).
Epidemiología
La prevalencia es mayor en lactantes y en mujeres adolescentes. Las diferencias entre distintos ámbitos dependerán principalmente de condicionantes socioeconómicos relacionados con la alimentación.
Estudios en países desarrollados han mostrado un considerable descenso en las últimas décadas, atribuido a la mejora de la nutrición y de programas preventivos. En los países subdesarrollados, la frecuencia es 2-4 veces superior. Los estudios en Europa varían entre un 9-34% de FP y un 3-8% de AF en niños entre 1-2 años, en función de condicionantes socioeconómicos de las poblaciones estudiadas, tales como edad de introducción de la LV, uso de fórmulas suplementadas en Fe y disponibilidad de alimentos ricos en Fe. En 2001, se publicó un subestudio del Euro-Growth(9) referente al estatus férrico determinado a la edad de 12 meses en 533 niños sanos de 10 países, que mostró un 7,2% de FP y un 2,3% de AF. En 2002, en Navarra, con una muestra de 94 lactantes, un estudio de prevalencia(10) encontró un 9,6% de FP y un 4,3% de AF. En edades posteriores, la prevalencia es menor (2-5% de FP y <1% de AF), con un repunte en las mujeres adolescentes(1).
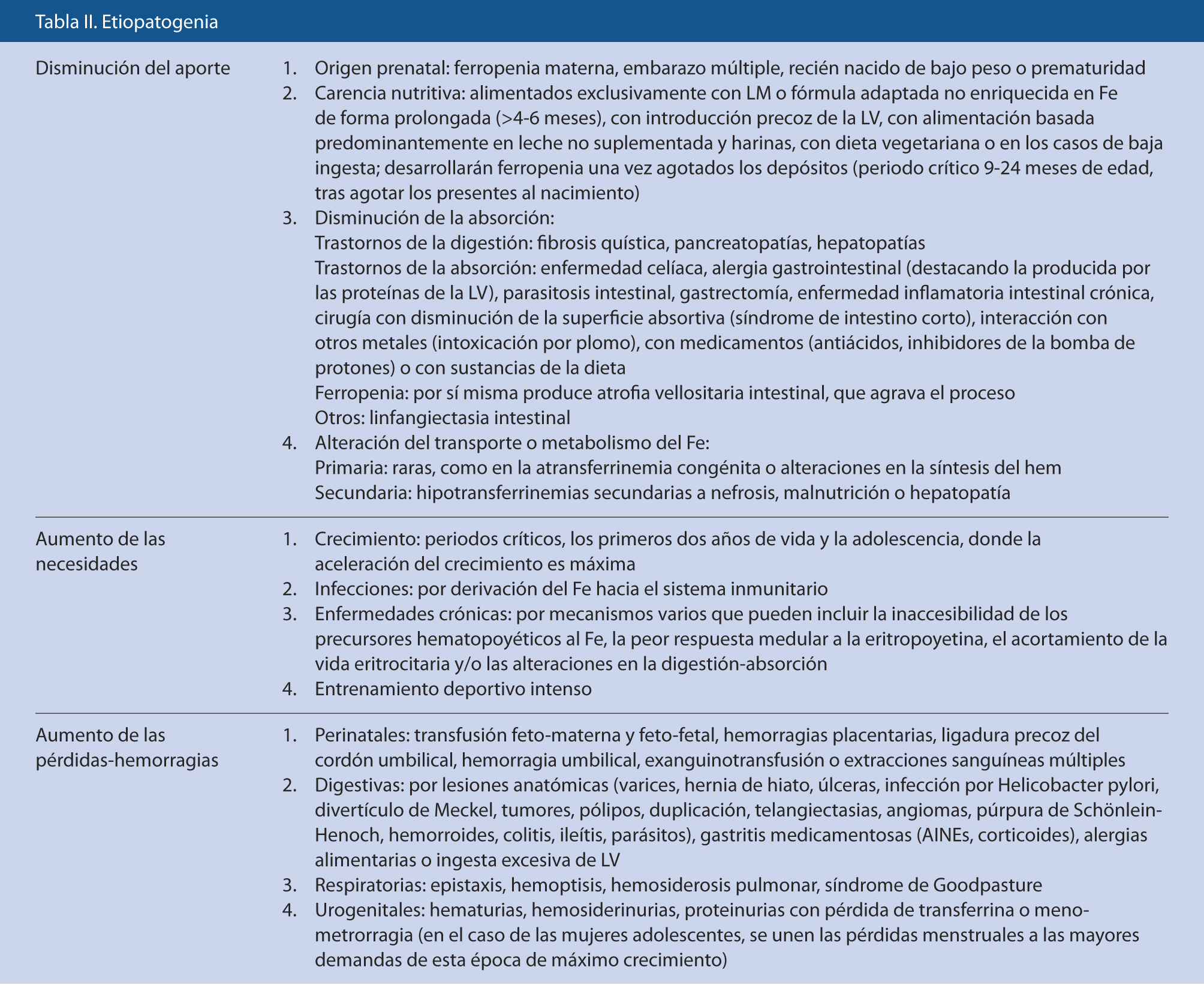
Etiopatogenia
La infancia tiene un riesgo elevado de ferropenia debido, fundamentalmente, a sus limitadas fuentes dietéticas de Fe y a las necesidades incrementadas del mismo por su crecimiento.
Distinguimos tres grupos fundamentales: disminución del aporte, aumento de las necesidades y aumento de las pérdidas (Tabla II). En todos los casos de AF y sobre todo en niños mayores, debe considerarse la pérdida de sangre como causa posible.
Fisiopatología
Tres situaciones progresivas en el déficit de hierro: ferropenia latente, ferropenia sin anemia (o ferropenia manifiesta) y anemia ferropénica.
Se distinguen tres estadios sucesivos, de intensidad creciente sintomática, en el déficit de Fe: 1) ferropenia latente: se inicia el vaciamiento de los depósitos férricos del SRE, primero en hígado y bazo y, después, en médula ósea, de curso asintomático; 2) ferropenia sin anemia: aumenta el déficit de Fe, con mayor afectación de los datos analíticos bioquímicos, aunque sin afectación del hemograma, y aparición de sintomatología atribuible al déficit de las enzimas tisulares que contienen Fe, pero sin clínica de anemia; y 3) anemia ferropénica: mayor afectación de las anomalías previas y alteraciones hematológicas propias, así como sintomatología de anemia.
Los síntomas iniciales de la carencia férrica afectan fundamentalmente a las funciones cerebral, digestiva e inmunológica, mejorando todas ellas cuando se corrige la FP. Algunas de las manifestaciones clínicas, sobre todo las relacionadas con el SNC, guardan relación con la función del Fe en determinadas reacciones enzimáticas, como las llevadas a cabo por la monoaminooxidasa, las catalasas, las peroxidasas y los citocromos. Algunos de los efectos a largo plazo sobre el SNC, en ocasiones persistentes incluso tras la corrección de la deficiencia de Fe, y sugeridos por estudios experimentales en animales, tendrían relación con alteraciones en el neurometabolismo, la mielinización y la función de los neurotransmisores durante la etapa de desarrollo cerebral(11). Una de las consecuencias, entre otras alteraciones neurobiológicas, sería la disminución en la velocidad de conducción visual y auditiva(6). La fisiopatología derivada de la disminución de Hb es común a otras anemias.
Clínica
Manifestaciones derivadas de la ferropenia y de la anemia. A destacar los efectos sobre la maduración cerebral del niño.
Ferropenia
• Repercusión sobre el SNC: irritabilidad, déficit de atención, dificultad de aprendizaje y disminución del rendimiento. Si sucede en épocas tempranas, estudios realizados(12,13) apuntan a una alteración en su maduración, con afectación de la función cognitiva, motora y conductual; dependiendo de la intensidad y duración de la ferropenia y de la edad a la que se produzca, algunos trastornos podrán ser irreversibles, incluso tras la corrección del déficit.
• Alteraciones dermatológicas: pelo ralo y escaso, uñas quebradizas, coiloniquia (en forma de cuchara), xerosis y descamación cutánea.
• Pica: trastorno de la conducta alimentaria, consistente en la ingestión de sustancias no nutritivas, como tierra (geofagia) o hielo (pagofagia), de patogenia desconocida.
• Alteraciones digestivas: anorexia (quizás la más precoz), queilitis angular, glositis, hipoclorhidria y atrofia vellositaria.
• Alteraciones inmunológicas: afectan a la quimiotaxis y la función bactericida de los neutrófilos y a otras formas de respuesta inmunitaria. En función de los datos epidemiológicos disponibles, no puede concluirse actualmente si favorece o dificulta las infecciones, pues los patógenos también precisan de Fe.
• Alteraciones en la termorregulación: menor respuesta adaptativa al frío.
• Relación con el trastorno por déficit de atención con hiperactividad, con el síndrome de las piernas inquietas, con alteraciones del sueño y con pausas de apnea.
Anemia
• Palidez, taquicardia, soplo cardíaco sistólico, dilatación cardíaca.
• Astenia y fatigabilidad excesiva.
• Predisposición al accidente cerebral vascular (stroke) en la infancia: la AF es 10 veces más frecuente en estos niños que en controles, y está presente en más de la mitad de estos niños sin otra enfermedad subyacente(14).
Diagnóstico
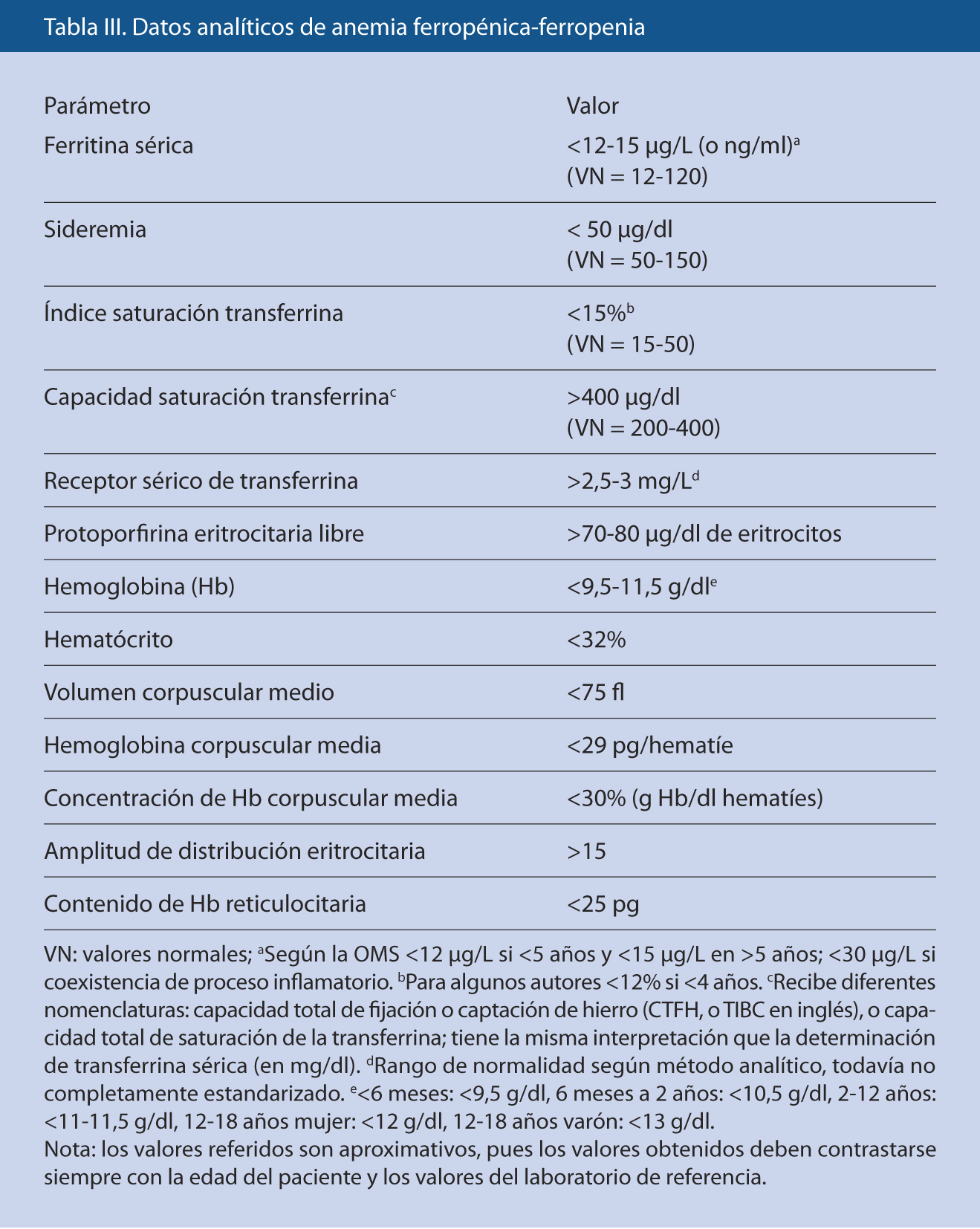
Ante la presencia de sintomatología sugestiva, por la pertenencia a grupos de riesgo o como hallazgo casual al realizarla por otro motivo, una analítica sanguínea nos confirmará el diagnóstico. La determinación de Ft sérica constituye, en general, el parámetro aislado accesible en Atención Primaria (AP) a fecha actual más fiable para valorar los depósitos de Fe.
Se produce una sucesión de acontecimientos bioquímicos y hematológicos conforme progresa la deficiencia de Fe, que culmina en la AF(8).
1. Disminución de los depósitos hísticos de Fe: hemosiderina en la médula ósea y Ft en suero.
2. Descenso de la sideremia.
3. Aumento de la Tf sérica y de la CTFH en el suero, con descenso del ISTf.
4. Acúmulo de protoporfirinas eritrocitarias libres (PEL), reflejo del paso limitante en la síntesis de Hb, ascenso del RsTf y descenso del contenido de Hb reticulocitaria (CHr)(15), que traducen la situación de eritropoyesis ferropénica.
5. Microcitosis e hipocromía: disminución del tamaño de los hematíes (VCM) y del contenido de Hb por hematíe (Hb corpuscular media, HCM), respectivamente.
6. Deformación de los eritrocitos, con poiquilocitosis (hematíes con forma diversa) y aumento de la ADE.
7. El recuento absoluto de reticulocitos está descendido (aunque el porcentaje relativo respecto al total de hematíes puede ser normal e incluso elevado); en grados severos, aparecen eritroblastos (hematíes nucleados) en sangre periférica.
Otros hallazgos presentes en la AF consisten en:
• Alteraciones de la serie plaquetar, con recuento leucocitario normal: trombocitosis ocasional por probable aumento de la eritropoyetina (similitud con la trombopoyetina), aunque en ocasiones puede aparecer trombocitopenia leve.
• Hipercelularidad de la médula ósea por hiperplasia eritroide, con normalidad de las series blanca y plaquetar; las tinciones férricas en las células reticulares medulares son negativas, como exponente de la ausencia de depósitos en estas células.
El diagnóstico puede resultar en ocasiones complejo debido a la subóptima sensibilidad y especificidad de los parámetros evaluados y a la relativa arbitrariedad de los límites de normalidad. El diagnóstico tradicional de FP se basa en una estrategia costosa, pues es necesario combinar varias determinaciones bioquímicas para aumentar la especificidad, no exenta de error, que incluye un descenso de la sideremia, del ISTf y de la Ft, y un aumento de la CTFH; mientras que, el diagnóstico de AF añade las alteraciones hematológicas. La sideremia es muy fluctuante, con amplio rango de normalidad que, además, desciende en los procesos infecciosos e inflamatorios. La Ft refleja de manera fidedigna los depósitos de Fe, pero con los inconvenientes de su variabilidad biológica y de su comportamiento como reactante de fase aguda. Más recientemente, se han añadido el aumento de las PEL y del RsTf(16), que no se alteran en los procesos infecciosos o inflamatorios, pero su complejidad técnica y los valores variables entre laboratorios limitan su uso, así como los índices reticulocitarios, especialmente el descenso del CHr, aunque sólo disponible en algunos contadores celulares. El RsTf se origina por escisión proteolítica del receptor específico situado en la superficie de todas las células del organismo a excepción de los eritrocitos maduros, siendo su concentración proporcional a la de éste, cuya expresión está en relación directa con los requerimientos de Fe intracelular.
Además de los datos de laboratorio (Tabla III), la existencia de una causa demostrable de carencia de Fe y la respuesta positiva a la ferroterapia apoyan claramente el diagnóstico de AF. El diagnóstico diferencial se debe realizar con otras entidades que cursan con anemia microcítica e hipocrómica, fundamentalmente con el rasgo talasémico, pero también con la intoxicación por Pb y la AEC.
Tratamiento
Cuatro opciones complementarias: etiológico, dietético, farmacológico y sustitutivo, en el que la ferroterapia oral a dosis de 3-5 mg/kg/d de Fe elemental ocupa un papel primordial.
Etiológico
Supresión del factor casual conocido o sospechado siempre que sea posible: corrección de los errores nutricionales, eliminación de la lesión anatómica sangrante, etc. En ocasiones, no corregiremos el déficit si no tratamos inicialmente la causa.
Dietético
En cualquier caso, pero especialmente si la etiología es nutricional, debe aumentarse el aporte de Fe dietético, fundamentalmente a través del incremento de alimentos de origen animal ricos en Fe. Una dieta rica en Fe consistirá en la ingesta de carne, pescado y/o huevos 1-2 veces al día, el consumo de cereales fortificados en Fe con el desayuno y/o merienda, la toma preferente de frutos cítricos como postre y el condimento con limón, así como limitada a 500 ml de productos lácteos, exenta en café y té, y evitando el exceso de leguminosas y verduras que dificulten la absorción de Fe. En los casos de hipersensibilidad a la proteína de la LV, ésta debe suprimirse o sustituirse por una fórmula apropiada.
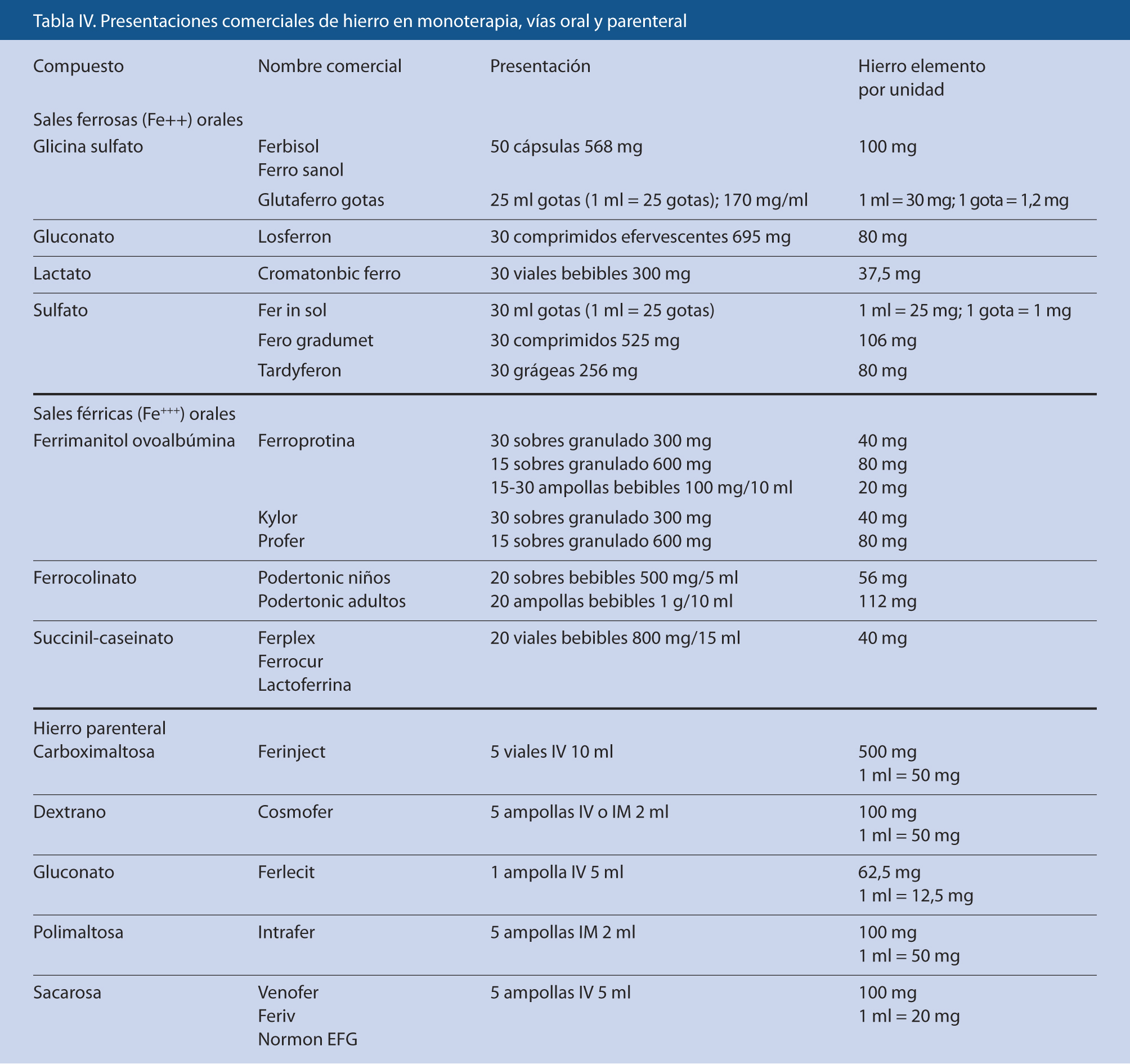
Farmacológico
De elección la vía oral (Tabla IV). Las sales ferrosas (gluconato, lactato, fumarato y, especialmente, sulfato) se absorben mejor y son más baratas. Salvo situaciones específicas, no se consigue ningún beneficio adicional significativo de administrarlo junto a otros hematínicos (fólico, B12, etc.), pero sí puede ser recomendable administrarlo con vitamina C o zumos de frutas ricos en ella. La dosis diaria recomendada de Fe elemental (equivalente al 20% del sulfato ferroso) es de 3-5 mg/kg/d, según gravedad, tolerancia y respuesta, dividida en 1-3 tomas. Los efectos secundarios gastrointestinales (pigmentación gingival o dental, anorexia, náuseas, vómitos, gastritis, heces oscuras, estreñimiento o diarrea) son relativamente frecuentes. Aunque la administración en ayunas aumenta su absorción, los efectos adversos pueden hacer recomendable administrarlo durante las comidas. Las sales férricas se administran con alimentos y suelen tener mejor sabor; hay que tener presente que por la posible presencia de ovoalbúmina o caseína en su composición pueden estar contraindicadas en algunos pacientes.
El Fe parenteral, excepcional en AP, se reserva exclusivamente para casos de malabsorción-malnutrición severa, de intolerancia oral o de incumplimiento terapéutico, pues la respuesta al mismo no suele ser más rápida y presenta una mayor toxicidad (a destacar el dolor intenso y la pigmentación permanente en la zona de administración intramuscular, y reacciones alérgicas en la vía endovenosa). En el caso del Fe sacarosa(6,17), la dosis total se calcula mediante la siguiente fórmula: Fe (mg) = [peso (kg) x (Hb deseada [g/dl] – Hb inicial [g/dl])] x 2,4 + depósito de Fe (mg); depósito de Fe: si <35 kg = 15 mg/kg peso; si > 35 kg = 500 mg. La dosis total es repartida en dosis cada 2 días (0,15 ml [= 3 mg Fe]/kg, diluido en infusión intravenosa lenta, dosis máxima 200 mg/d, no más de 3 por semana).
Si el diagnóstico y el tratamiento son correctos, existirá una mejoría medular rápida, en 24-48 horas, y una mejoría hematológica en sangre periférica, con respuesta reticulocitaria, máxima a los 3-7 días, que propicia un dimorfismo en la población de hematíes (una antigua microcítica e hipocroma, otra nueva de características normales), y un aumento progresivo de la Hb (mínimo de 1 g/dl al mes). La Hb suele normalizarse en 1-2 meses de tratamiento, pero debe continuarse la ferroterapia a las mismas dosis durante 2-3 meses más para rellenar los depósitos. La respuesta es tan evidente que su ausencia debe hacer replantearnos el diagnóstico y/o tratamiento. Las causas de AF refractaria al tratamiento con Fe son: 1) diagnóstico incorrecto, sobre todo con otros tipos de anemia hipocrómica y microcítica; 2) enfermedad intercurrente-concomitante que disminuye su absorción y/o utilización (por ejemplo, enfermedad celíaca); 3) pérdidas mantenidas de sangre oculta; 4) errores dietéticos persistentes (por ejemplo, alto consumo de LV); y 5) incorrecta administración del Fe, lo más frecuente (fórmula galénica de Fe poco absorbible, rechazo de la medicación por sus efectos secundarios, infradosificación, etc.).
Hay que evitar los tratamientos inade-
cuados, pues el aporte de Fe presenta posibles efectos adversos y acarrea unos riesgos(6) todavía por determinar: debido a su potencial oxidativo, puede contribuir a la generación de radicales libres, con actividad proinflamatoria y posible aumento futuro de la incidencia de aterogénesis o de cáncer; un exceso del aporte puede interferir con la absorción de otros micronutrientes, como el cinc, y, en diversos estudios en niños sanos con depósitos adecuados, se ha observado un retraso en los incrementos de peso y/o talla; por otra parte, la mayor biodisponibilidad del Fe a los patógenos puede favorecer la reactivación o progresión de ciertas infecciones, como la malaria u otras. Pese a que algunos de estos hechos son controvertidos, sin datos concluyentes al respecto y de escasa magnitud, indican una alerta sobre la ausencia de inocuidad de la ferroterapia.
Sustitutivo
Sólo en casos severos hospitalarios con signos de disfunción cardíaca o infección concomitante, mediante transfusión lenta de concentrado de hematíes (+/- furosemida) a dosis de 2-3 ml/kg.
Prevención
Recomendaciones nutricionales para todos y suplementación con Fe y/o despistaje analítico en niños con determinados antecedentes o condiciones que les hacen propensos al déficit férrico.
Recomendaciones nutricionales generales(1,4,6,7): LM exclusiva 4-6 meses, uso de fórmulas lácteas fortificadas en Fe para los lactantes no amamantados, uso de cereales suplementados con Fe a partir de los 4-6 meses de edad, asegurar ingesta de alimentos ricos en Fe hem y vitamina C a partir de los 6 meses, no usar fórmulas no enriquecidas en Fe y LV antes del año de edad y evitar el exceso de productos lácteos (>500 ml/d) o de alimentos ricos en sustancias que dificulten la absorción de Fe. A nivel obstétrico, es una práctica universal la suplementación con ferroterapia oral a la mujer gestante, de la que se beneficiará el futuro recién nacido al evitar los estados de ferropenia materna, y es recomendable la ligadura del cordón umbilical tras 2-3 minutos desde el nacimiento.
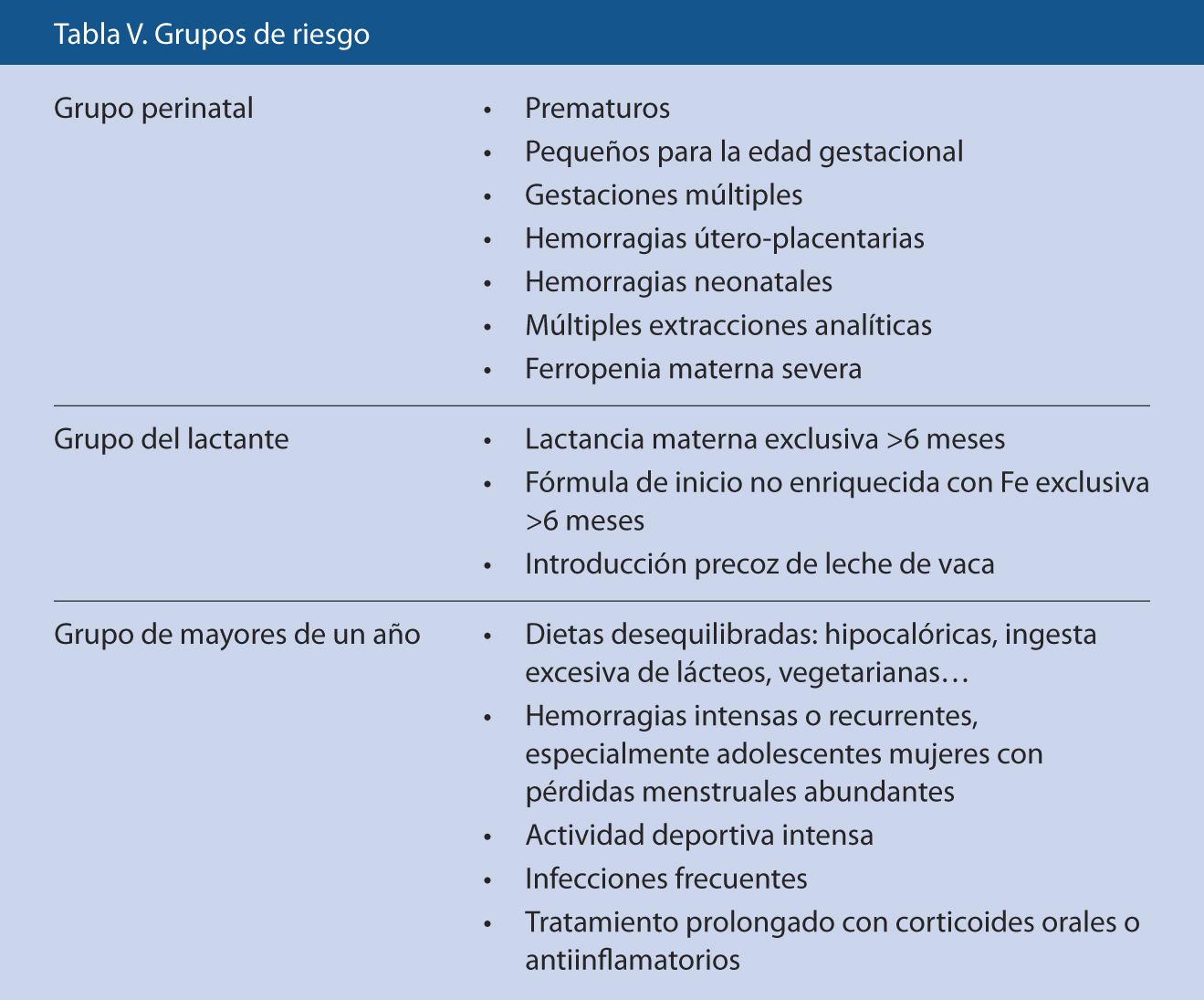
Suplementación de Fe medicinal para algunos grupos de riesgo(4,7) (Tabla V): para el grupo perinatal se recomienda ferroterapia oral a dosis de 2-4 mg/kg/d desde el primer-segundo mes en los prematuros (mayor dosis cuanta menor edad gestacional o peso al nacimiento), y desde el cuarto-sexto mes en el resto del grupo, durante al menos 3 meses o hasta el año de edad; para el grupo del lactante, dosis de 1 mg/kg/d a partir del cuarto-sexto mes, hasta que se corrijan las situaciones nutricionales adversas. La dosis total diaria no sobrepasará los 15 mg y hay que tener en cuenta lo aportado por la alimentación al calcular la dosis a suplementar.
La suplementación universal con Fe a edades tempranas, además del efecto preventivo frente a la AF posterior, ha mostrado ciertos beneficios en el desarrollo cerebral en algunos estudios, pero estos datos son todavía inconsistentes para convertirlos en una recomendación y conllevaría unos riesgos comentados en el apartado previo; actualmente, en países de nuestro entorno, sólo se recomienda la prevención a los grupos de riesgo(7). Otro aspecto controvertido sería la indicación o no de una analítica de despistaje a una edad determinada: de la misma forma expresada anteriormente, estaría indicada en aquellos grupos de riesgo ya referidos, tanto para indicar la suplementación como para controlar la duración de la misma, pero no de una manera universal. Estas indicaciones podrían no ser las mismas para poblaciones con prevalencias más elevadas de FP-AF(4,18).
Función del pediatra de Atención Primaria
El pediatra de AP es el encargado de llevar a cabo las medidas preventivas, tanto de las recomendaciones nutricionales a toda la población como de la suplementación farmacológica en los grupos de riesgo referidos. Deberá estar atento a solicitar un despistaje analítico en todas las condiciones en que pueda existir un compromiso del estatus férrico, realizar un diagnóstico diferencial básico en las anemias microcíticas detectadas y, si se confirma la FP-AF, además de diagnosticar y corregir las causas que la han producido, tratarla adecuadamente hasta su normalización. En casos de AF refractaria, una vez descartadas las causas solucionables desde AP, o si presentan otras patologías, se valorará remitir para seguimiento especializado.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Arias MA. Anemias en la infancia y otros trastornos eritrocitarios. En: Del Pozo J, Redondo A, Gancedo MC, Bolívar V, eds. Tratado de pediatría extrahospitalaria. 2ª ed. Madrid: Ergon SA; 2011. p. 825-41.
2. Glader B. Anemias por producción inadecuada. DeBaun MR, Vichinsky E. Hemoglobinopatías. Markowitz M. Intoxicación por plomo. En: Kliegman R, Behrman R, Jenson H, Stanton B, eds. Nelson. Tratado de Pediatría. 18ª ed esp. Barcelona: Elsevier España, SL; 2009. p. 2006-18, 2032-7 y 2913-7.
3. Irwin J, Kirchner J. Anemia in children. Am Fam Physician. 2001; 64: 1379-86.
4.* Janus J, Moerschel S. Evaluation of anemia in children. Am Fam Physician. 2010; 81: 1462-71.
5. Ferrara M, Capozzi L, Russo R, Bertocco F, Ferrara D. Reliability of red blood cell indices and formulas to discriminate between beta thalassemia trait and iron deficiency in children. Hematology. 2010; 15: 112-5.
6.*** Monteagudo E, Ferrer B. Deficiencia de hierro en la infancia. Acta Pediatr Esp. 2010; 68: 245-51 y 305-11.
7.*** Moráis A, Dalmau J, Comité de Nutrición de la AEP. Importancia de la ferropenia en el niño pequeño: repercusiones y prevención. An Pediatr. 2011; 74: 415.e1-415.e10.
8. Cruz M. Anemias nutricionales. En: Cruz M, ed. Tratado de pediatría. 9ª ed. Madrid: Ergon SA; 2006. p. 1491-5.
9. Male C, Persson LA, Freeman V, Guerra A, van’t Hof MA, Haschke F, and the Euro-Growth Iron Study Group. Prevalence of iron deficiency in 12-mo-old infants from 11 European areas and influence of dietary factors on iron status (Euro-Growth study). Acta Pediatr. 2001; 90: 492-8.
10. Durá C, Díaz L. Prevalencia de la deficiencia de hierro en lactantes sanos de 12 meses de edad. An Esp Pediatr. 2002; 57: 209-14.
11.** Lozoff B, Beard J, Connor J, Felt B, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006; 64: S34-S43.
12. Lozoff B, Georgieff MK. Iron deficiency and brain development. Semin Pediatr Neurol. 2006; 13: 158-65.
13. McCann JC, Ames BN. An overview of evidence for a causal relation between iron deficiency during development and deficits in cognitive or behavioral function. Am J Clin Nutr. 2007; 85: 931-45.
14. Maguire JL, de Veber G, Parkin PC. Association between iron-deficiency anemia and stroke in young children. Pediatrics. 2007; 120: 1053-7.
15.* Mateos ME, de la Cruz J, López E, Valdés MD, Nogales A. Revisión de los parámetros hematológicos y bioquímicos para identificar la ferropenia. An Pediatr. 2009; 71: 95-102.
16. Aleo E, Gil C, González FA, Villegas A, Valverde F. Receptor sérico de transferrina en niños sanos. Valor diagnóstico en la anemia infecciosa y en la ferropénica. An Pediatr. 2004; 60: 428-35.
17. Rodríguez A, Moreno JM, Rodríguez A, Espín B, Pizarro A, Rodríguez JR. Administración de hierro intravenoso en niños. Aspectos prácticos. Acta Pediatr Esp. 2007; 65: 579-83.
18. Coyer SM. Anemia: diagnosis and management. J Pediatr Health Care. 2005; 19: 380-5.
Bibliografía recomendada
– Arias MA. Anemias en la infancia y otros trastornos eritrocitarios. En: Del Pozo J, Redondo A, Gancedo MC, Bolívar V, eds. Tratado de pediatría extrahospitalaria. 2ª ed. Madrid: Ergon SA; 2011. p. 825-41.
Capítulo excelente sobre anemias especialmente dirigido al pediatra de Atención Primaria.
– Monteagudo E, Ferrer B. Deficiencia de hierro en la infancia. Acta Pediatr Esp. 2010; 68: 245-51 y 305-11.
Completa y actualizada revisión sobre la anemia ferropénica.
– Moráis A, Dalmau J, Comité de Nutrición de la AEP. Importancia de la ferropenia en el niño pequeño: repercusiones y prevención. An Pediatr. 2011; 74: 415.e1-415.e10.
Puesta al día de las consecuencias y de los aspectos nutricionales y preventivos de la ferropenia.
– Mateos ME, de la Cruz J, López E, Valdés MD, Nogales A. Revisión de los parámetros hematológicos y bioquímicos para identificar la ferropenia. An Pediatr. 2009; 71: 95-102.
Revisión de los aspectos diagnósticos en la ferropenia, aboga por la realización del CHr junto a los parámetros hematológicos, sin precisar los parámetros bioquímicos.
– Lozoff B, Beard J, Connor J, Felt B, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006; 64: S34-S43.
Exhaustivo análisis de las consecuencias de la ferropenia en el desarrollo cerebral, explicando sus posibles mecanismos.
| Caso clínico |
|
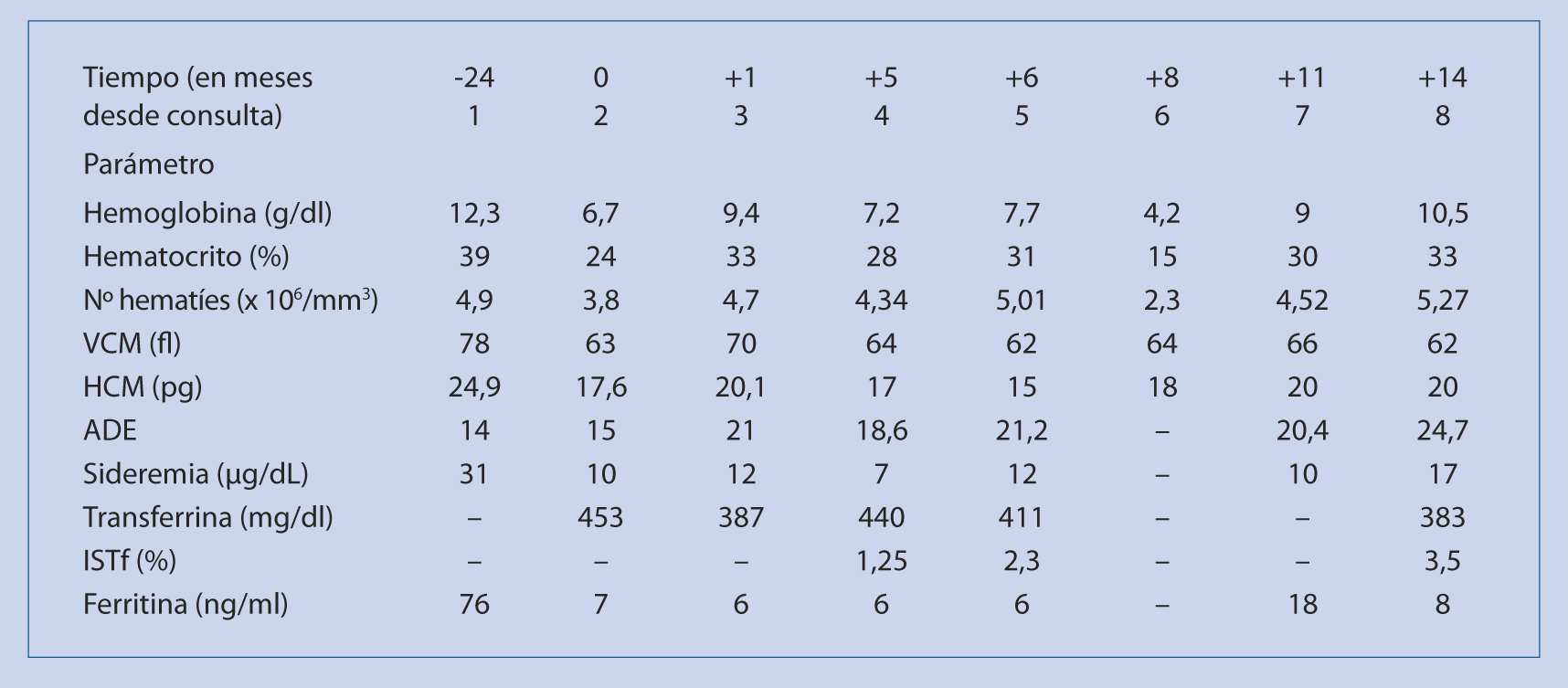
Adolescente mujer de 12 años, etnia sudamericana, menarquia desde los 11 años y medio, consulta por menstruaciones abundantes y prolongadas (fórmula menstrual 10-12 días/30 días) desde el inicio de la menarquia, además de referir mareos ocasionales y cefalea. En la exploración se aprecia palidez cutáneo-mucosa, sin otros hallazgos relevantes. No antecedentes personales o familiares de interés. Dos años antes, se le había realizado una analítica1 general al venir con su familia inmigrante a nuestro país, con resultados normales, incluida Hb = 12,3 g/dl. En analítica2 se confirma anemia microcítica-hipocroma severa con Hb: 6,7 g/dl, VCM: 63 fl y HCM: 17,6 pg, y ferropenia marcada, con resto dentro de la normalidad. Se pauta ferroterapia con ferroglicina sulfato 100 mg/día en dosis única oral, consejos dietéticos y derivación ginecológica. Un mes después se comprueba mejoría clínica (remisión de la cefalea y los mareos) y analítica3 (Hb: 9,4 g/dl); por lo que se decide continuar con misma ferroterapia durante 3 meses más. Valorada por ginecólogo, no se aprecian hallazgos patológicos, incluida ecografía ginecológica normal, por lo que no considera preciso tratamiento etiológico. En control analítico4 tras un mes sin ferroterapia, se objetiva empeoramiento (Hb: 7,2 g/dl), por lo que se reinicia misma ferroterapia previa; sin embargo, en un nuevo control analítico5 un mes después, sólo se aprecia una leve mejoría (Hb: 7,7 g/dl). Aunque la anemia es clínicamente bien tolerada, dadas la anemia ferropénica refractaria y la persistencia de su hipermenorrea, se cursa propuesta para valoración hospitalaria especializada. Unos días antes de su citación en consulta externa presenta empeoramiento de sus pérdidas ginecológicas y aumento de la sintomatología clínica, acudiendo a urgencias hospitalarias6, donde se comprueba cierta inestabilidad hemodinámica y Hb: 4,2 g/dl, por lo que se decidió ingreso hospitalario, transfusión de concentrado de hematíes y continuación de la ferroterapia oral. Revalorada ginecológicamente, se decide instaurar tratamiento hormonal oral (Progyluton®: 11 días valerato de estradiol 2 mg solo, 10 días unido a norgestrel 0,5 mg, 7 días descanso); alta hospitalaria con Hb: 8 g/dl. Dos meses tras el ingreso hospitalario, se encuentra asintomática, con normalización de ciclo menstrual (5 días/28 días) y cifra de Hb: 9 g/dl7, y en nuevo control analítico8 3 meses después del anterior se objetiva Hb: 10,5 g/dl. |