La ósmosis un proceso muy importante tanto a nivel químico como biológico.
Pero, ¿qué es la ósmosis? La ósmosis es un fenómeno en el que se produce el paso o difusión de un disolvente a través de una membrana semipermeable, la cuál permite el paso del disolvente pero no el del soluto, desde una disolución más diluida a otra más concentrada.
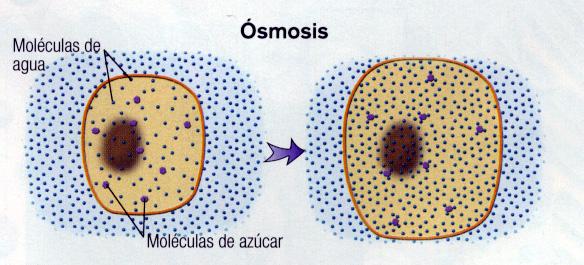
La capacidad que tiene el agua de atravesar la membrana plasmática, que se comporta como una membrana semipermeable, depende de la diferencia de concentración entre los líquidos extracelular e intracelular y viene determinada por la presencia de sales minerales y moléculas orgánicas disueltas.
Los medios acuosos separados por membranas semipermeables pueden tener diferentes concentraciones, y se denominan:
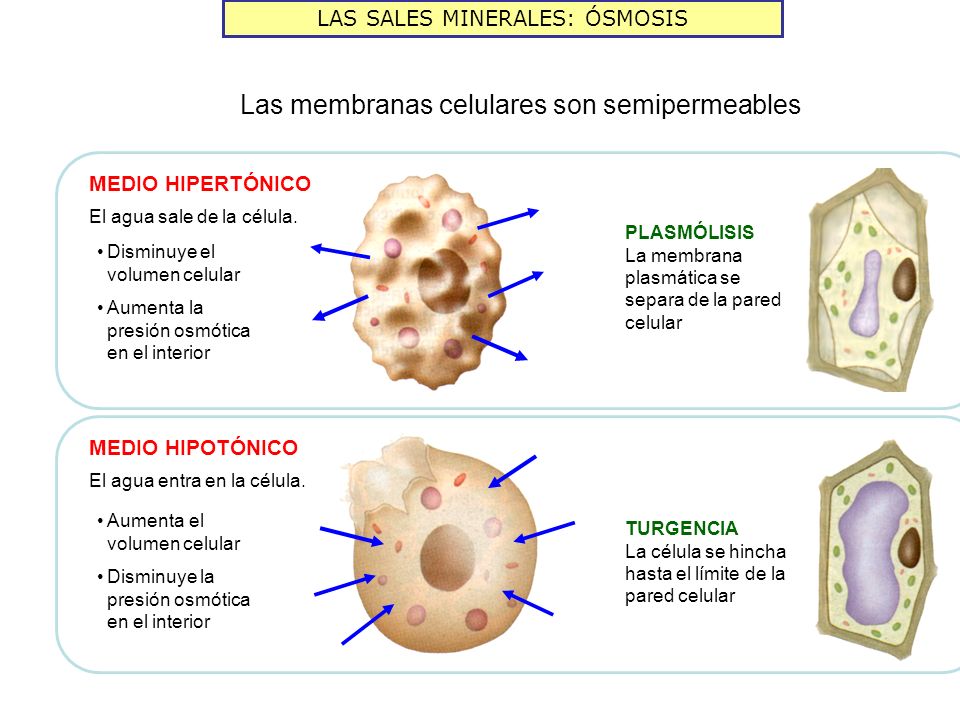
- Hipertónicos, los que tienen una elevada concentración de solutos con respecto a otros en los que la concentración es inferior.
- Hipotónicos, los que contienen una concentración de solutos baja con respecto a otros que la tienen superior.
Las moléculas de agua difunden desde los medios hipotónicos hacia los hipertónicos provocando un aumento de la presión sobre la cara de la membrana del compartimento hipotónico, denominada presión osmótica. Como consecuencia del proceso osmótico se puede alcanzar el equilibrio, igualándose las concentraciones, y entonces los medios serán isotónicos, es decir que tienen la misma concentración.

Ósmosis en la cocina
No somos conscientes pero podemos ver la ósmosis en nuestra cocina: cuando hervimos pasta o arroz, cuando preparamos papas arrugadas, al poner hojas de lechuga o legumbres de remojo
Si ponemos una hoja de lechuga seca en agua, ésta recupera en unas cuantas horas toda su textura. La lechuga había perdido el agua, y la recupera gracias a la ósmosis.
Un experimento muy sencillo de realizar para demostrar este hecho se puede realizar con dos huevos de gallina, vinagre y dos disoluciones: una muy concentrada en algún soluto (por ejemplo sal) y otra con únicamente agua destilada.
Como podemos ver en el experimento, el huevo que está en una disolución muy concentrada de sal (hipertónica), tiende a expulsar el agua, quedando mas arrugado, mientras que cuando está en agua destilada (disolución hipotónica), éste se infla. Se puede realizar el mismo experimento probando diferentes disoluciones concentradas con solutos de mayor tamaño que la sal y observar el efecto de una manera mas drástica (por ejemplo con jarabe de glucosa o con azúcar).
La presión hidrostática que ejerce el agua para entrar o para salir se denomina presión osmótica y viene regulada por las concentraciones y la temperatura.
¿Que pasaría con nuestras células?
En los siguientes vídeos puedes ver glóbulos rojos en una disolución hipertónica y en una disolución hipotónica. Cuando los glóbulos rojos están en una solución hipertónica, para igualar concentración liberan agua, quedándose «secos», lo que provoca su muerte.
Cuando la disolución es hipotónica, los glóbulos rojos tienden a coger agua e inflarse, provocando en ocasiones la rotura o lisis celular.
En las siguientes imágenes se muestra el resultado de la siguiente experiencia:
Los glóbulos rojos de una misma persona fueron introducidos en tres soluciones distintas:
- Isotónica. Los eritrocitos fueron depositados en un recipiente conteniendo suero sanguíneo.
- Hipotónica. Los eritrocitos fueron introducidos en un recipiente conteniendo plasma sanguíneo diluido con agua.
- Hipertónica. Los eritrocitos fueron colocados en un recipiente conteniendo plasma sanguíneo al que se le ha añadido una solución concentrada de NaCl.